Азотын фиксаци
Азотын фиксаци нь, Дэлхийн атмосфер дахь азотыг (N2) нийлмэл (ж. нь, аммиак - NH4+ эсвэл азотын давхар исэл - NO
2) болгон хувиргаж буй процесс юм.[1] Атмосферийн азот буюу молекул азот (N2) нь харьцангуй инерт учир, бусад химийн элемент эсвэл бодистой урвалд орж өөр нэгдэлийг хялбар үүсгэдэггүй. Фиксацийн процессийн үед азотын атомууд, азотын диатомт молекулын гурвалсан холбооноос (N≡N) чөлөөлөгдөж, өөрөөр ашиглагдах боломжтой болдог.
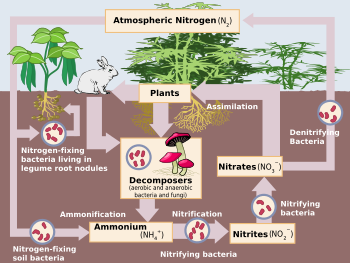
Азотын фиксаци нь, байгалийн ба синтетик, бүхий л амьд организмуудад чухал ач холбогдолтой, учир нь азот нь ургамал, амьтан болон бусад амьд организмуудын барилгын материалуудын (ДНХ ба РНХ-ийн нуклеотидууд; уургуудын амин хүчлүүд) биосинтезэд оролцдог. Азотын фиксаци нь, газар тариалан болон бордооны үйлдвэрлэлийн чухал процесс юм. Дээрхээс гадна, тэсрэх бодисын (дарь, динамит, ТНТ, г.м.) үйлдвэрлэлд өргөн ашиглагддаг. Байгальд, азотын фиксацийн процесс нь, цахилгаан цохих үед явагддаг.[2][3]
Бүх биологийн азотын фиксаци нь, нитрогеназа гэгдэх, төмөр-молибден ховор тохиолдолд төмөр-ванади агуулах металлт энзимүүдээр явагддаг. Азотыг фиксацилах чадвартай микроорганизмууд, нян ба архей аль аль нь, прокариотууд юм. Азотыг фиксацилах чадвартай организмуудыг нийтэд нь диазотропууд гэж нэрлэдэг. Зарим дээд ургамлууд ба зарим амьтад (термит) диазотропуудтай симбиозыг үүсгэдэг.
Биологийн азотын фиксаци
засварлахБиологийн азотын фиксацийг Германы агрономч Герман Хелльригель[4] ба Данийн микробиологич Мартин Бейеринк[5] нар нээсэн. Нитрогеназа гэдэг фермент агаарын азотыг аммони болон хувигах процессийг биологийн азотын фиксаци (БАФ) гэж нэрлэдэг.[1] Биологийн азотын фиксаци нь дараах ерөнхий урвалаар явагдана:
- N2 + 8 H+ + 8 e− → 2 NH3 + H2
Биологийн азотын фиксацийн процесс нь АТФ-ын 16 эквивалентын гидролизтой хослох ба ингэхдээ нэг H2 молекулыг дундаасаа хамтран бий болгоно.[6] N2 -ыг аммони болгох хувиргалт нь төмөр-молибдений кофактор (FeMoco гэж нэрлэгдэх) металл кластер дээр явагдана. Механизм нь хэд хэдэн протонжуулалт ба ангижруулалтын шатуудаас тогтох ба үүнд төмөр-молибдений кофакторын идэвхтэй хэсэг нь N2 -ын субсратыг гидрогенжуулна.[7]
Эх сурвалж
засварлах- ↑ 1.0 1.1 Postgate, J. (1998). Nitrogen Fixation, 3rd Edition. Cambridge University Press, Cambridge UK.
- ↑ Slosson, Edwin (1919). Creative Chemistry. New York: The Century Co. pp. 19–37.
- ↑ http://journals.ametsoc.org/doi/abs/10.1175/1520-0469%281980%29037%3C0179%3AANFBL%3E2.0.CO%3B2
- ↑ Hellriegel, H.; Wilfarth, H. (1888). Untersuchungen über die Stickstoffnahrung der Gramineen und Leguminosen [Studies on the nitrogen intake of Gramineae and Leguminosae]. Berlin: Buchdruckerei der "Post" Kayssler & Co.
- ↑ Beijerinck, M. W. (1901). "Über oligonitrophile Mikroben" [On oligonitrophilic microbes]. Centralblatt für Bakteriologie, Parasitenkunde, Infektionskrankheiten und Hygiene. 7 (2): 561–582.
- ↑ Chi Chung, Lee; Markus W., Ribbe; Yilin, Hu (2014). "Chapter 7. Cleaving the N,N Triple Bond: The Transformation of Dinitrogen to Ammonia by Nitrogenases". In Kroneck, Peter M. H.; Sosa Torres, Martha E. (eds.). The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences. Vol. 14. Springer. pp. 147–174. doi:10.1007/978-94-017-9269-1_6.
- ↑ Hoffman, B. M.; Lukoyanov, D.; Dean, D. R.; Seefeldt, L. C. (2013). "Nitrogenase: A Draft Mechanism". Acc. Chem. Res. 46: 587–595. doi:10.1021/ar300267m.
Гадаад холбоос
засварлах- Hirsch, Ann M. (2009). "A Brief History of the Discovery of Nitrogen-fixing Organisms" (PDF). University of California, Los Angeles. Эх хувилбараас (PDF) архивласан: 2010-07-09. Татаж авсан: 2016-12-17.
- "Marine Nitrogen Fixation laboratory". University of Southern California.