Энзим: Засвар хоорондын ялгаа
Шинэ хуудас: thumb|200px| Триозефосфат изомераза хэмээх ферментийн туузан загвар. '''Фермент... |
(Өөрчлөлт алга)
|
09:10, 20 Нэгдүгээр сар 2011-ий байдлаарх засвар
Фермент (энзим) бол эсийн дотор химийн урвалыг хурдасгах (удаашруулах) үйл ажиллагааг явуулдаг уурагийн молекул юм. .[1] Ферментүүд нь биед явагдах химийн урвалыг хурдасгадаг боловч тухайн үйл явцыг бүрэн дүүрэн хянадаггүй.
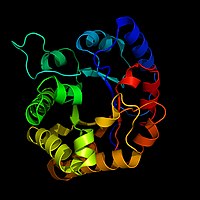
Амьд биед явагдах ихэнх биохимиийн урвалуудад ферментүүд шаардлагтай байдаг. Ферментийн оролцоотой урвалууд бусад урвалаас хурдан явагддаг.
Урвалын эхэнд оролцож байгаа химийн бодисыг субстрат гэж нэрлэдэг. Энэ субстратууд нь химийн урвалын эцэст урвалын бүтээгдэхүүн болж хувирдаг. Өөрөөр хэлбэл фермент субстратуудтай ажиллаж тэдгээрийг бүтээгдэхүүнд хувиргадаг.
Ферментийн бүтэц
Enzyme structure
Химийн бүтэцийн хувьд ферментүүд уураг учир олон амин хүчлүүдээс тогтсон өндөр молекулт нэгдэл юм. Эдгээр амин хүчлүүд нь пептид холбоогоор хоорондоо урт гинжилсэн байдалтай холбогдож, улмаар энэ гинж нугарч мушгирч нарийн нийлмэл бүтэцийг үүсгэдэг.
Ферментүүдэд субстраттай холбогдох хэсэг байдаг. "сарвуу, ан, хонхорхой,гүдгэр зэрэгээр тухайн молекулд атгах, барих, тэлэх, нугаллах зэргээр үйлчлэл үзүүлдэг".[2]p37
Мянга мянган өөр өөр ферментүүд байдаг.Ферментүүдийн нэр нь тэдгээрийг ямар фермент болохыг нь илтгэдэг. Ферментийн нэрс голтөлөв –ase төгөсгөлтэй байх ба энэ тухайн нэрийн цаана фермент байгааг илэрхийлдэг. Жишээ нь ATP synthase гэж нэртэй фермент байхад уг фермент ATP(гурван фосфорт аденазин)-ийг нийлэгжүүлдэг фермент гэж ойлгогдоно. Өөр нэг жишээ татахад DNA polymerase (ДНХ полимераза)гэдэг фермент бол ДНХ-н хуучин нэг гинжийг хэрэглэн шинэ гинж нийлэгжүүлдэг.
Шүлсний амилаза фермент нь цардуулын том молекулыг задлаж глюкоз ба мальтозын жижиг молекул болгодог байхад өөр нэг төрлийн Лифаза ферментүүд өөх тосны молекулыг жижиг молекулд хувиргадаг гэх мэт олон жишээ татаж болно. Протеазууд бол ферментийн нэгэн анги бөгөөд тэдгээр нь бусад фермент ба уургийг задлаж амин хүчилд хувиргадаг.[3]
Ферментүүд нь том химийн бодисыг жижиг химийн бодист хувиргаад зогсохгүй эсрэгээр жижиг химийн бодисоос том нийлмэл хиймийн бодис үүсгэх болон бусад химийн хувиралуудыг мөн гүйцэтгэдэг. Ферментүүдийн ангилал нь доор бичигдсэн үндсэн хэлбэрүүдэд хуваагддаг.
Биохимичид ферментийг зургийг загвар үзүүлэн хэрэглэн зурдаг. Ферментийн дотор олон мянган атом байх учир бүрэн дүрслэхэд хүндрэлтэй байдаг. Биохимичид ферментийг бүрэн нарийвчлан дүрслэхийн оронд туузан загварыг ашигладаг. Туузан загвар нь ферментэд байх атом бүрийг үзүүлэхгүйгээр ферментийн ерөнхий хэлбэрийг төлөөлөн харуулдаг.
Ихэнх ферментүүд тохирсон температур pH орчингүйгээр ажиллахгүй. сүүгээр божигч амьтадын биеийн дулаан 37oC degrees байдаг тул ихэнх ферментийн ажиллах хэм болдог. Харин pH -ийн хувьд нилээд өргөн хүрээтэй. Жишээ нь Пепсин pH 1.5 орчим байхад ажилладаг.[4]
Тухайн нэг темпратурын болсгоос хэтрүүлэн халаахад ферментийг дахиж сэргэхгүйгээр эвддэг. хэрэв фермент протеазын нөлөөгөөр задарсан бол түүний бүрэлдэхүүн химийн бодисыг дахин хэрэглэж болдог.
Зарим хиймийн бодисууд ферментийн үйл ажиллагааг дэмжиж болдог. Эдгээрийг идвэхжүүлэгч(активатор)гэж нэрлэдэг. ферментийн үйлчлэлийг удаашруулах болон зогсох үйлчилгээтэй бодисууд байдагийг саатуулагч (ингибиторууд) гэж нэрлэдэг. ихэнхи эмүүд нь хүний биед байгаа ферментүүдийг хурдасгах болон удаашруулах үйлчилгээтэй химийн бодисууд байдаг.
Үйл ажиллагаа
Аливаа ферментет урвалын ерөнхий тэгшитгэл нь:
- Субстрат + Фермент –> Субстрат:Фермент –> Бүтээгдэхүүн:Фермент –> Бүтээгдэхүүн + Фермент
Жишээ нь Сахраза нь түүний субстрат болон сахрозоос 400 дахин том бөгөө Сахарозыг түүнийг бүрдүүлэгч сахарууд болгон задладаг. Эдгээр сахарууд нь глюкоз фруктозууд байдаг. сахраза сахрозыг нугалан глюкоз, фруктозын хоорондох химийн холбоог хүчлэн салгадаг. Үүн дээр усны молекул холбогдож хоёр хэлсгийг бүрэн салгадаг. ферментүүд нь дараах үндсэн шинж чанаруудтай байдаг:
- Тэдгээр нь урвалыг хурдасгах чанартай. ферментүүд урвалын эрчимийг 10 сая дахин нэмэгдүүлдэг.[2]p39 Урвалын явцад фермент өөрөө өөрчлөгддөггүй.
- Ферментүүд жижиг хэмжээтэй байсан ч үйллэлтэй. Нэг ферментийн молекул 1000 субстратын молекулыг нэг минутад хувиргаж болох ба зарим фермент нэг минутад 3 сая субстратыг хувиргадаг.[2]p39
- Тэдгээр нь ихээхэн өвөрмөц. Нэг фермент тухайн субстратаас явагдаж болох олон урвалуудаас зөвхөн нэгийг явуулдаг.
Ферментийн идвэхийг хянах
Ферментийн идвэхийг эсийн төвшинд хянадаг таван үндсэн арга зам байдаг.
- Эсийн орчин өөрчлөгдөхөд ферментийн нийлэгжлийг(тухайн ферментийн генийн транскрипц ба трансляци) ихэсгэж багасгаж болдог.Генийн зохицуулгын энэ хэлбэрийг ферментийн индукц ба ингибиц гэж нэрлэдэг. Жишээ нь пенициллин зэрэг антибиотикт тэсвэртэй бактер пенициллиний молекулыг задралд оруулдаг ферментийг нийлэгжүүлдэг.
- ферментүүд эсийн өөр өөр хэсгүүдэд тохиолдож болно. Жишээ нь Өөхний хүчил эсийн цитозол, эндоплазмын тор, гольджийн аппаратад байх нэг хэсэг ферментүүдийн үйл ажиллагааны үр дүнд нийлэгжээд митохондрид байх арай өөр хэсэг бүлэг ферментийн үйлчлэлээр энергийн эх үүсвэр бий болдог.[5]
- Ферментүүд өөрсдийн бүтээгдэхүүнээрээ зохицуулагдаж болдог. Жишээ нь эсийн бүтээгдэхүүн тухайн бодисын нийлэгжих замын эхний ферментүүдийн нэгийг дарангуйлдаг. For example, the end product(s) often inhibit one of the first enzymes of the pathway. Бүтээсэн эцсийн бүтээгдэхүүний хэмжээгээр түүний өөрийн концентраци зохицуулагддаг учир ийм зохицуулгын зарчмыг сөрөг буцалттай гэж нэрлэдэг.Энэ нь эцсийн бүтээгдэхүүнийг хэтэхий их хэмжээгээр үйлдвэрлэхээс хамгаалдаг. Ферментийн үйл ажиллагааны энэ хяналт нь амьд биеийн тогтвоттой дотоод орчин буюу гоместазыг хэрэгжүүлэхэд тусладаг.
- ферментүүд урвалыг явуулсныхаа дараа өөрчлөгдөх байдлаар зохицуулагдаж болно. Enzymes can be regulated by being modified after their production. Жишээ нь полипептидийн гинж тасрах. Хоол болосруулахад оролцодог протеазе болох химотрипсин нойр булчирхайд байхдаа идвэхгүй хэлбэрт байж байгаад ходоодонд орохдоо идвэхждэг. энэ нь тэр ферментийг нойр булчирхай ба нарийн гэдсэнд орохыг өмнө бусад эдийг гэмтээхээс хамгаалдаг.ферментийн анхны идвэхгүй хэлбэрийг зимоген гэдэг.
- Зарим фермент өөр орчинд (Өндөр pH тайгаас бага pH тай орчинд) шилжихдээ идвэхжиж болдог Some enzymes may become activated when they move to a different environment (e.g. from high pH to low pH). Жишээ нь Томуугийн вируcын Хемагглютинин хэлбэр өөрчлөгдөхөд идвэхждэг. Энэ хэлбэрийн өөрчлөлт нь эзэн эсийн лизосомын дотор орход орчны хүчиллэг өөрчлөгдөхөөс хамаардаг.[6]
Кофакторууд
Кофакторууд буюу коэзимүүд нь урвалыг явуулахад шаардлагатай туслагч молекулууд юм. тэдгээр нь уургийн бус органик ба органик бус молекулууд байдаг. ЭНэ төрлийн молекулууд нь заримдаа Mg2+, Cu2+, Mn2+, iron-sulphur багцаар гэх мэт металлын ионыг төвдөө агуулдаг. эдгээр металлууд электрон донорыг үүрэгтэй учир олон урвалын хувьд маш чухал байдаг. витамин гэх мэт олон төрлийн ферментийн жижиг туслагчууд ийм л үндсэн шалтгааны улмаал амьтадад хэрэгцээтэй байдаг.[7][8]
Ангилалзүй
Биохимийн олон улсын холбоо (International Union of Biochemistry)-ны ферментийн комисс бүх нээгдээд байгаа ферментүүдийг зургаан бүлэгт хуваадаг. үүнд:
- ОксидоРедуктаза: электрон зөөвөрлөхийг хурдасгадаг
- Трансферазууд: нэг молекулаас нөгөөд функционал бүлгийг зөөдөг
- Гидролазууд: –OH (гидроксил)-ийн бүлгийг нэмдэг
- Лиазууд: химийн холбоонуудыг салгаж шинэ давхар холбоо эсвэл цагираг бүтэцийг үүсгэдэг
- Изомеразууд: A –> B Эндээс B нь A гийн изомер болдог.
- Лигазууд: Хоёр том молекулыг нэгтгэдэг: Ab + C –> A–C + b
Тухайн нэг фемент тэдгээрийн ангилал зүйгээс хамаарсан дөрвөн тоогоор нэглэгддэг.[9]p145[10]
References
- ↑ Concise Oxford Dictionary.
- ↑ 2.0 2.1 2.2 Kornberg, Arthur 1989. For the love of enzymes: the odyssey of a biochemist. Harvard. ISBN 0-674-30775-5
- ↑ Pugh, Maureen Barlow (ed) 2000. Stedman's medical dictionary, 27th ed. Baltimore, Maryland, USA: Lippincott, Williams & Wilkins. p65
- ↑ "Effects of pH". Retrieved 2010-04-29.
- ↑ Faergeman NJ, Knudsen J (1997). "Role of long-chain fatty acyl-CoA esters in the regulation of metabolism and in cell signalling". Biochem. J. 323 (Pt 1): 1–12. PMC 1218279. PMID 9173866.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Carr C.M. & Kim P.S. (2003). "A spring-loaded mechanism for the conformational change of influenza hemagglutinin". Cell. 73: 823–32. doi:10.1016/0092-8674(93)90260-W. PMID 8500173.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Sauke, David J.; Metzler, David E. and Carol M. 2001. Biochemistry: the chemical reactions of living cells. 2nd ed, Harcourt/Academic Press, San Diego. ISBN 0-12-492540-5
- ↑ Bugg, Tim 1997. An introduction to enzyme and coenzyme chemistry. Blackwell, Oxford. ISBN 0-86542-793-3
- ↑ King R.C. Stansfield W.D. & Mulligan P.K. 2006. A dictionary of genetics, 7th ed. Oxford.
- ↑ Enzyme database [1]
Загвар:Link FA Загвар:Link FA Загвар:Link FA Загвар:Link FA Загвар:Link FA Загвар:Link FA Загвар:Link FA Загвар:Link FA